工作动态

原发性肺癌罕见靶点靶向治疗中国临床诊疗指南(2024 版)
2024-08-23 15:34:28

中国医师协会肿瘤多学科诊疗专业委员会 国家肿瘤质控中心肺癌质控专家委员会
通信作者:王洁,国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院 北京协和医学院肿瘤医院内科,北京 100021,Email:zlhuxi@163.com;赫捷,国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科,北京 100021 ,Email:prof.jiehe@gmail.com
【摘要】目前,肺癌在中国恶性肿瘤中的发病率和死亡率均居首位 。驱动基因突变的发现为精准医学提供了有力的治疗手段,靶向治疗已成为肺癌诊疗指南中的重要部分,越来越多的罕见突变靶向药物有效改善了肺癌患者的生存。根据世界卫生组织指南制定手册的原则和方法,中国医师协会肿瘤多学科诊疗专业委员会和国家肿瘤质控中心肺癌质控专家委员会在整合罕见靶点检测方法、治疗药物临床研究新进展,并结合国内外诊疗指南及中国实际国情和临床实践的基础上,制定原发性肺癌罕见靶点靶向治疗中国临床诊疗指南,旨在指导中国肺癌罕见靶点诊疗临床实践,完善规范化诊疗体系,提高中国肺癌诊疗水平。
【关键词】肺肿瘤;罕见突变;靶向治疗;指南
DOI:10. 13455/j.cnki.cjcor. 113494-2024-2024-0127
Clinical guidelines for targeted therapy of rare variants in primary lung cancer in China (2024 edition)
Multidisciplinary Committee of Oncology, Chinese Physicians Association Lung Cancer Expert Committee of National Cancer Quality Control Center
Corresponding author:Wang Jie, Department of Medical Oncology, National Cancer Center/ National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking union Medical College, Beijing 100021, China, Email: zlhuxi@163. com; He Jie, Department of Thoracic Surgery, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking union Medical College, Beijing 100021, China, Email: prof.jiehe@gmail.com
【Abstract】 Currently, lung cancer ranks first in both incidence and mortality rate among malignancies in China. The discovery of oncogenic driver mutations provides a powerful strategy for precision medicine. Targeted therapies have become an essential treatment in guidelines worldwide. Emerging rare variants-targeted drugs improve patient survival effectively. Following the World Health Organization's Handbook for Guidelines Development, this guide integrates rare variants detection assay and new progress in clinical research on therapeutic drugs, combines domestic and foreign diagnosis and treatment guidelines with China's national conditions and clinical practices, and formulates the guideline for the clinical diagnosis and treatment of primary lung cancer targeted therapy forrare variants in China. This guideline aims to standardize the clinical practice of rare variants diagnosis and treatment of lung cancer, improve the standardized diagnosis and treatment system, and improve the level of lung cancer diagnosis and treatment in China.
【Key words】 Lung neoplasms; Rare variants; Targeted therapy; Guideline
DOI: 10. 13455/j.cnki.cjcor. 113494-2024-2024-0127
一、前言
肺癌是目前全球最常见的恶性肿瘤之一,其发病率和死亡率常年位居前列。近年来,肺癌在我国持续位居发病率和死亡率之首。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的80%,在过去十余年的综合治疗发展历程中,精准医学理念在很大程度上改变了晚期NSCLC患者的治疗方案格局,针对驱动基因突变的小分子靶向药物在肺癌药物治疗中的重要性逐渐凸显。相对于传统化疗方案,靶向治疗显著提高了部分携带有敏感突变晚期NSCLC患者的客观缓解率(objective response rate,ORR),延长患者的无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS),改善了患者的生存质量。目前,针对东亚NSCLC人群中最常见的表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变的靶向药物研发进展迅速,治疗成效显著,已有多种国内外研制的EGFR突变靶向药物在我国获批用于治疗EGFR敏感突变阳性的晚期NSCLC患者。近年来,随着检测技术、药物研发和临床试验的不断发展,如间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合、c-ros癌基因1(c-ros oncogene 1,ROS1)融合、转染重排因子(rearranged during transfection,RET)融合、间质-上皮转化因子(mesenchymal-epithelial transition,MET)突变或扩增、鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF)突变、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)突变或扩增、鼠类肉瘤病毒癌基因(kirsten ratsarcoma viral oncogene,KRAS)突变、神经营养性酪氨酸受体激酶(neurotrophic tyrosine receptor kinase,NTRK)融合等多种罕见靶点在全球范围内涌现出许多新型靶向治疗药物,在临床实际使用中取得良好的治疗效果。
驱动基因在西方国家与我国肺癌患者中的分布情况有所不同。我国肺腺癌患者最常见的驱动基因突变为EGFR突变(约50%),而西方国家人群肺腺癌中最常见的为KRAS基因突变(约25%~32%)。罕见突变东西方人群中发生率无明显差异,ALK融合、MET扩增、MET 14外显子跳跃突变、HER-2扩增等少见基因突变在肺癌患者中分别占3%~5%,其余罕见突变如ROS1融合、BRAF V600、RET融合等约占肺腺癌的1%~2%,NTRK融合基因在NSCLC中的发生率仅为0.2%,上述驱动基因突变通常不与其他驱动基因共存。
正确开展分子病理检测、获得准确分子靶向信息对于肿瘤精准治疗的开展至关重要。目前,国内外肺癌诊疗指南均建议对初诊的肺腺癌(包括含有腺癌成分的NSCLC或小标本送检)患者进行分子基因检测。常用分子病理检测方法包括Sanger测序、荧光原位杂交(fluorescence in situ hybridization,FISH)、实时荧光聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)、免疫组织化学染色(immunohistochemistry staining,IHC)、二代测序技术(next generation sequencing,NGS)等,不同类型的靶分子基因存在优选的检测手段。目前,根据我国已获批适应证的靶向药物及美国食品药品监督管理局(Food and Drug Administration,FDA)获批的相关适应证,对晚期非鳞 NSCLC建议确诊后进行EGFR、ALK、ROS1(证据级别:1 类,推荐级别:强)、MET 14外显子跳跃突变、RET融合、BRAF V600(2类,强)基因检测;而在特定人群中,可考虑进一步开展对MET扩增、HER-2突变、KRAS突变、NTRK1、NTRK2、NTRK3(2类、中)等多种基因变异的扩展检测。鳞状NSCLC,尤其小标本活检病理,也可考虑上述基因检测(2 类,中),证据级别及推荐级别见指南编写方法学。目前,多数建议检测的基因变异已有相应国内外获批药物适应证,可有效改善患者的生存和预后。
二、指南编写方法学
本指南在《中华医学会肺癌临床诊疗指南》《2024CSCO非小细胞肺癌诊疗指南》《Ⅳ期原发性肺癌中国治疗指南》《非小细胞肺癌分子病理检测临床实践指南(2021)》《非小细胞肺癌融合基因检测临床实践中国专家共识(2023版)》《NCCN非小细胞肺癌临床实践指南2024.v2》等国内外最新指南与专家共识的基础上,结合本研究领域新发表的临床研究证据及实践经验,由专家组组长与执笔作者整理出初稿,其后由专家组成员对指南内容进行讨论、修改和投票,对指导意见进行推荐等级分类,制定出《原发性肺癌罕见靶点靶向治疗中国临床诊疗指南》,以期为肺癌领域各级临床医师提供具有循证依据的专业性、指导性意见,规范临床诊疗常规,为患者提供更优质、规范化的治疗策略。
通过Pubmed、EMBASE、Web of Science等3个国际文献数据库平台及万方医学中文数据库平台进行文献检索,检索出版时间为2010年1月31日至2024年1月31日。在Pubmed、EMBASE、Web of Science等数据库平台中检索关键词为“non-small cell lung cancer[Title/Abstract]”“Proto-Oncogene Proteins c-met[MeSH Terms]”“c-met”“MET”“Anaplastic Lymphoma Kinase[MeSH Terms]”“anaplastic lymphoma kinase”“ROS1 protein,human[MeSH Terms]”“ros1”“Proto-Oncogene Proteins B-raf[MeSH Terms]”“B Raf kinase”“NTRK fusion”“NTRK fusion[Title/Abstract]”“ntrk”“protein ret”“Proto-Oncogene Proteins c-ret[MeSH Terms]”“KRAS[Title/Abstract]”“KRAS”“Receptor,ErbB-2[MeSH Terms]”“epidermal growth factor receptor 2”,文献类型为“Review”“Systematic Review”“Meta-Analysis”“Randomized Controlled Trial”。在万方医学中文数据库平台检索关键词为主题:(c-MET)(ALK)(ROS1)(BRAF)(NTRK)(RET)(KRAS)(HER2);题名或关键词:(肺癌);关键词:(综述)(荟萃分析)(随机对照)。检索文献类型限制为系统综述、荟萃分析、随机对照临床研究,除外重复文献、既往更新的临床研究、述评、来信、新闻报道、编辑点评等文献。基于上述检索策略,获得各类型罕见靶点相关英文文献2 929 篇,中文文献 63篇,总计2 992篇。证据级别及推荐级别分类见表1、2。

本指南项目组预先设定了罕见靶点检测、治疗相关问题,发给国家肿瘤质控中心肺癌质控专家委员会及中国医师协会肿瘤多学科诊疗专业委员会专家代表进行投票,收集投票结果,并请每位专家提供支持问题答案的证据和相关材料。在随后进行的共识研讨会上,参会专家对上述问题和循证医学证据进行了充分讨论,并进行第二轮投票。
三、罕见靶点
(一)ALK
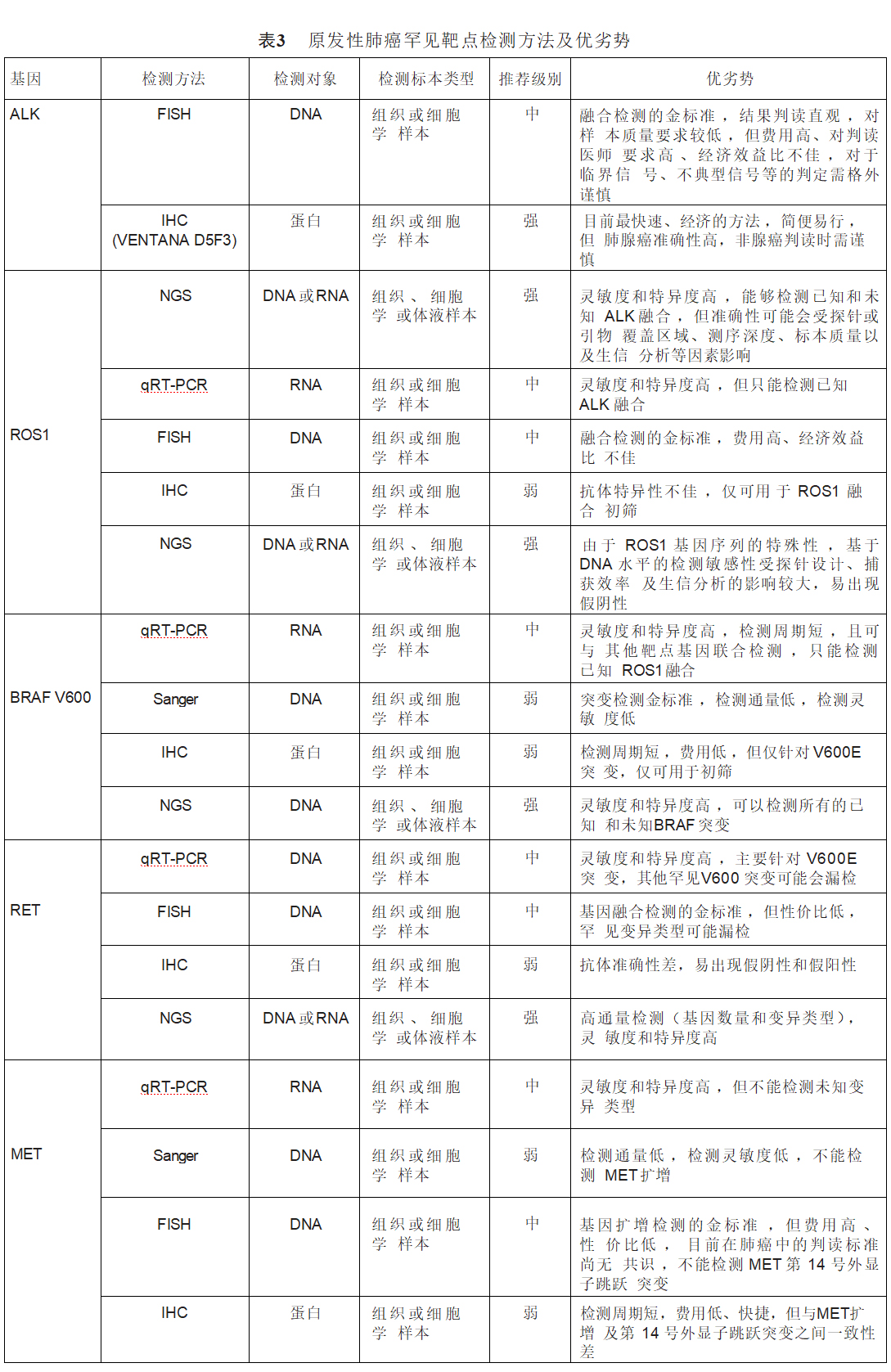
ALK是一种原癌基因,也是一种跨膜受体酪氨酸激酶,属于胰岛素受体超家族成员。ALK信号通路在恶性肿瘤细胞中主要通过基因融合、基因扩增和激活点突变3种机制被激活。ALK融合阳性在NSCLC中的发生率约为3%~7%,中国肺腺癌人群发生ALK融合的阳性率为5.1%。ALK基因重排导致ALK融合基因的表达。目前可用于检测ALK融合的方法有FISH、qRT-PCR、IHC和NGS。FISH为金标准,在DNA水平上检测ALK基因重排,结果判读直观,但费用高、对判读医师要求高、经济效益比不佳。IHC(特别是ALK Ventana D5F3 IHC检测方法)检测ALK融合蛋白表达是目前最快速、经济的方法。qRT-PCR可以检测ALK融合mRNA,但只能检测已知的ALK融合。NGS可以检测DNA水平上的重排序列或mRNA水平上的融合序列,其灵敏度和特异度均较高,也被强烈推荐用于ALK融合的检测(表3)。
1.治疗推荐
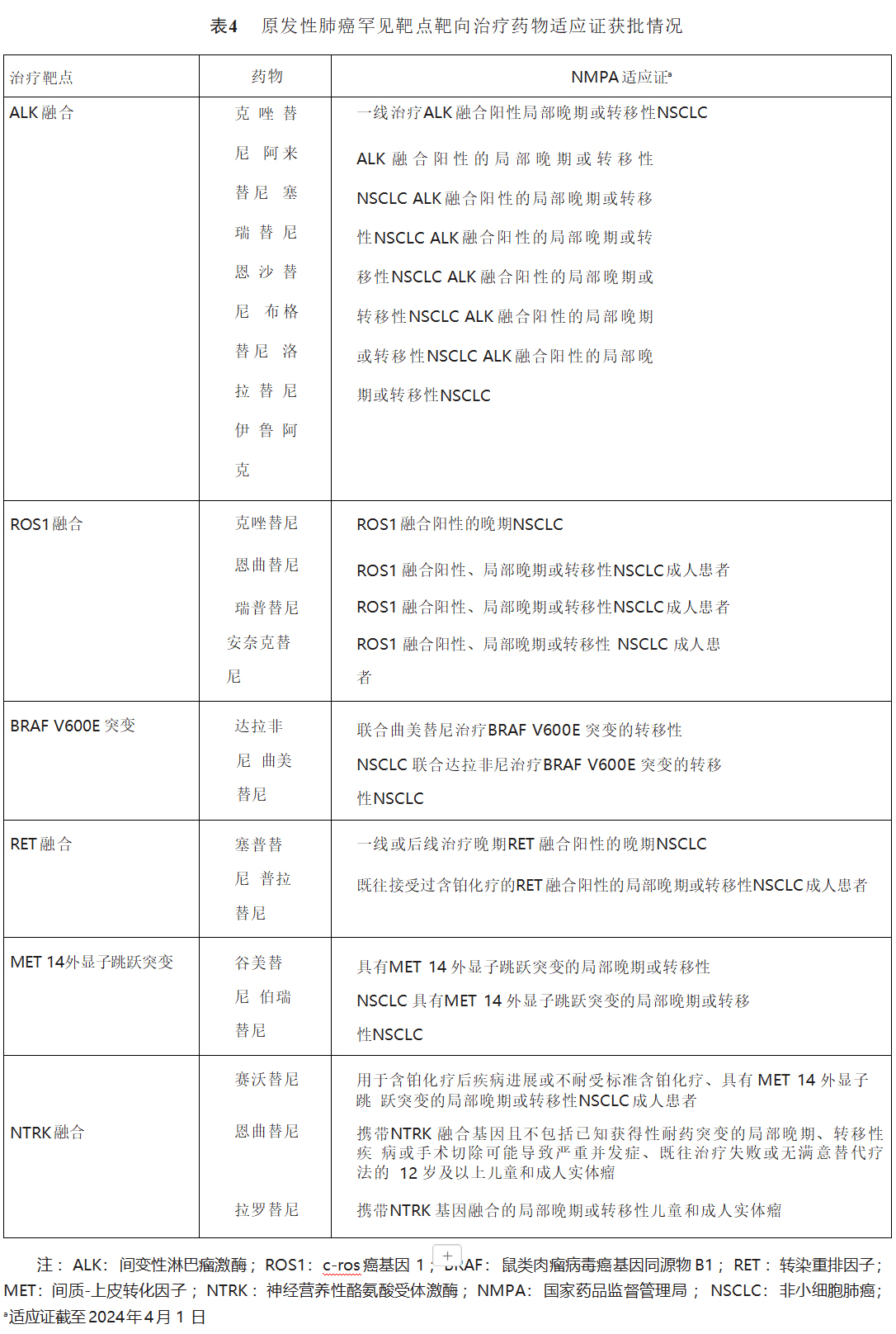
(1)ALK融合阳性患者一线治疗:对于ALK融合阳性患者一线治疗推荐使用克唑替尼、阿来替尼、塞瑞替尼、恩沙替尼、布格替尼、洛拉替尼、伊鲁阿克(1类,强),见表4。
(2)ALK融合阳性患者后线治疗:对于ALK融合阳性患者一线克唑替尼治疗耐药后推荐使用阿来替尼、塞瑞替尼(1类,强)、恩沙替尼、布格替尼、洛拉替尼、伊鲁阿克(3类,强),见表4。第一代或第一、二代ALK-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)均治疗失败者可选择洛拉替尼(1类,强)。对于第一、二、三代ALK-TKI均治疗失败的患者,参照驱动基因阴性晚期 NSCLC治疗策略,推荐含铂双药化疗联合或不联合贝伐珠单抗(1类,强)。对于靶向治疗及含铂双药治疗均失败的患者,可予以单药化疗、单药化疗+贝伐珠单抗或安罗替尼方案。
(3)ALK融合阳性患者辅助治疗:对于ⅠB~ⅢA期根治性术后ALK融合阳性患者,推荐使用阿来替尼辅助治疗2年(1类,中)。
2.ALK融合阳性Ⅳ期NSCLC的治疗推荐证据
(1)ALK融合阳性晚期NSCLC的一线治疗:克唑替尼作为全球首个获批用于ALK融合阳性晚期NSCLC一线治疗的一代ALK-TKI药物,Ⅰ期研究PROFILE 1001展现出克唑替尼良好的耐受性。Ⅱ期单臂多中心研究PROFILE 1005进一步确认克唑替尼的安全性和有效性,ORR为53%,中位PFS为8.5个月;最常见的不良反应(adverse events,AE)为视觉异常、胃肠道反应,大多为 1~2级。Ⅲ期随机对照研究PROFILE 1014证实了克唑替尼一线治疗的疗效优于含铂双药化疗,中位PFS显著延长(分别为10.9和7.0个月,P<0.000 1),ORR显著提高(分别为74%和45%,P<0.000 1)。长期随访结果显示,PROFILE 1014研究在允许交叉的情况下仍然观察到克唑替尼组OS的显著获益(4年总生存率分别为56.6%和49.1%)。针对ALK阳性东亚患者的Ⅲ期PROFILE-1029研究也达到了主要研究终点。
阿来替尼是一种具有高度选择性的第二代ALK-TKI。Ⅲ期临床研究ALEX对比了阿来替尼和克唑替尼一线治疗ALK融合阳性晚期NSCLC患者的疗效,阿来替尼组和克唑替尼组患者的中 位PFS分别为34.8和10.9个月(HR=0.43,P<0.000 1),5年生存率分别为62.5%和45.5%。此外,日本J-Alex研究显示,阿来替尼组中位PFS显著优于克唑替尼组。在亚洲人群中进行的一线治疗Ⅲ期ALK 融合阳性NSCLC患者的ALESIA研究结果显示,阿来替尼组对比克唑替尼组的中位PFS显著延长(分别为41.6和11.1个月,HR=0.33,95%CI:0.23~0.49,P<0.000 1),ORR亦显著优于克唑替尼组(分别为91%和77%,P=0.009 5)。对于基线中枢神经系统(central nervous system,CNS)转移患者,阿来替尼相比克唑替尼可显著提高CNS转移的ORR(分别为94.1%和28.6%)。在安全性方面,阿来替尼组的3~5级AE(分别为48%和54.8%)及严重AE(分别为28%和29%)的发生率均低于克唑替尼组。
ASCEND-4研究显示,塞瑞替尼(750 mg/d)一线治疗ALK融合阳性NSCLC患者的中位PFS显著优于化疗组(分别为16.6和8.1个月,HR=0.55,P<0.000 01)。值得注意的是,塞瑞替尼组中有80.3%的患者可能由于药物AE导致剂量调整、中断或延迟,这部分患者可能影响了塞瑞替尼的整体疗效结果。ASCEND-8研究进一步设计了塞瑞替尼450 mg/d随餐、塞瑞替尼600 mg/d随餐、塞瑞替尼750 mg/d空腹治疗3个队列,结果显示,3种剂量、服用方式组的稳态血药浓度相当,疗效相近,450 mg/d组胃肠道AE最低,依从性和安全性更佳,目前我国说明书塞瑞替尼推荐剂量为450 mg/d随餐。ASCEND-7研究纳入ALK融合阳性的脑和(或)脑膜转移NSCLC患者,根据患者既往是否接受过脑放疗或克唑替尼治疗进行分组,塞瑞替尼在各组中均有获益。
eXalt3研究显示,既往未接受TKI治疗的ALK融合阳性晚期NSCLC患者,恩沙替尼组和克唑替尼组的中位PFS分别为31.3和12.7个月,ORR分别为74%和67%,恩沙替尼组最常见的AE为皮疹和肝功能损伤(37.8%)。
ALTA-1L研究显示,布格替尼相比克唑替尼一线治疗ALK融合阳性晚期NSCLC患者能显著延长中位PFS(分别为24.0和11.1个月),3年生存率分别为71%和68%,4年生存率分别为66%和60%;对于基线脑转移的患者,布格替尼也显示出更佳的颅内控制效果,CNS转移的ORR分别为78%和26%。
CROWN研究纳入ALK融合阳性晚期NSCLC初治患者,洛拉替尼组和克唑替尼组的1年无进展生存率分别为78%和39%(HR=0.28,95%CI:0.19~0.41,P<0.000 1),洛拉替尼组的ORR和颅内病灶ORR均显著优于克唑替尼组。
伊鲁阿克是一种新型ALK或ROS1-TKI。INSPIRE研究在既往未接受过ALK-TKI治疗的ALK阳性晚期NSCLC患者中评价伊鲁阿克对比克唑替尼的疗效和安全性,结果显示,伊鲁阿克组和克唑替尼组的中位PFS分别为27.7月和14.6个月(HR=0.34,P<0.000 1),耐受性良好。
(2)ALK融合阳性晚期NSCLC的后线治疗:ALK-TKI靶向治疗耐药分为原发性耐药和获得性耐药。原发性耐药患者较少,潜在的耐药机制暂不明确。多数患者属于获得性耐药,获得性耐药机制主要分为药物靶点变异(包括ALK激酶域二次突变和ALK拷贝数增加)、旁路激活及其他耐药机制。ALK激酶结构域突变是最常见的ALK-TKI耐药机制之一。阿来替尼最常见的耐药激酶结构域突变为 G1202R,通过空间位阻限制TKI结合激酶活性部位,洛拉替尼可以克服G1202R耐药;其次是V1180L、L1196M、I1171N/S/T,塞瑞替尼、洛拉替尼、布格替尼在小样本病例中报道对V1180L、L1196M突变有效。旁路信号通路激活主要有RAS/RAF/MEK/ERK-MEK等通路激活,针对此类耐药患者,可考虑联合其他靶向药物。其他耐药机制还包括表型改变,如腺癌向小细胞肺癌转化、腺癌向鳞癌转化、上皮间叶转化(epithelial-mesenchymal transitions,EMT)等。对一、二代 ALK-TKI均治疗失败的患者,可进行活检评估耐药机制。
一线应用ALK-TKI进展后,根据进展部位和是否寡进展划分为寡进展或CNS进展型和广泛进展型。对于寡进展或CNS进展患者,可继续服用原ALK-TKI,并针对局部病灶进行治疗。对于广泛进展的患者,建议更换治疗方案。
NP28673研究显示,对克唑替尼耐药的ALK融合阳性患者接受阿来替尼治疗的ORR为50%,中位持续缓解时间(duration of response,DOR)为11.2个月,中位PFS为8.9个月;CNS转移的疾病控制率(disease control rate,DCR)达 83%,CNS转移的中位DOR为10.3个月;大多数AE为1~2级(便秘、乏力、外周水肿)。Ⅲ期临床研究ALUR纳入克唑替尼及含铂化疗治疗失败的ALK融合阳性晚期NSCLC患者,阿来替尼组和化疗组的中位PFS分别为10.9和1.4个月(HR=0.20,P<0.001),ORR分别为50.6%和2.5%,CNS转移的ORR分别为66.7%和0。
ASCEND-5研究纳入既往接受化疗、克唑替尼治疗后进展的ALK融合阳性晚期NSCLC患者,塞瑞替尼组较化疗组的PFS和ORR显著获益。ASCEND-2研究显示,对克唑替尼耐药的ALK融合阳性NSCLC患者,接受塞瑞替尼治疗的ORR和DCR分别为38.6%和77.1%,中位PFS为5.7个月,CNS转移的ORR为45.0%。而对于阿来替尼治疗后耐药的患者,ASCEND-9研究显示,塞瑞替尼治疗的ORR和DCR分别为25.0%和70.0%,中位PFS达3.7个月,1年生存率为75.6%。
一项纳入160例经克唑替尼治疗后耐药患者的Ⅱ期研究中,克唑替尼治疗耐药后的患者接受恩沙替尼治疗的ORR为52%,CNS转移的ORR为70%,90%的患者出现治疗相关AE,但大多为 1~2级。基于上述研究,恩沙替尼在国内已获批上市。
Ⅱ期研究ALTA评价了90 mg和180 mg 2种剂量的布格替尼在克唑替尼治疗后耐药患者中的疗效,两组的ORR分别为45%和54%,中位PFS分别为9.2和12.9个月,CNS转移的ORR分别为42%和67%,常见的AE为恶心、腹泻、头痛和咳嗽,大多为1~2级。
此外,洛拉替尼的Ⅱ期研究显示,在既往接受过至少一种ALK抑制剂治疗的患者中,洛拉替尼治疗的ORR为47%,CNS转移的ORR为63%,最常见的3~4级AE为高胆固醇血症和高甘油三酯血症。
INTELLECT Ⅱ期临床研究评估了伊鲁阿克在ALK阳性NSCLC一线克唑替尼治疗失败患者中的疗效,结果显示,独立评审委员会(Independent Review Committee,IRC)评估的ORR为69.9%,中位PFS为19.8个月,中位OS未达到;在基线脑转移患者中,伊鲁阿克的颅内缓解率达64%。
(3)ALK融合阳性NSCLC患者术后辅助治疗:ALINA研究是首个关注可切除ALK阳性NSCLC术后辅助治疗的Ⅲ期研究,纳入ⅠB~ⅢA期ALK阳性NSCLC患者,接受阿来替尼或含铂化疗。2023年欧洲肿瘤学会(European Society for Medical Oncology,ESMO)公布的数据显示,在意向性分析(intention to treat,ITT)患者中,与含铂化疗相比,阿来替尼术后辅助治疗可显著延长无病生存时间(diseasefree survival,DFS),3年无病生存率分别为54.0%和88.7%(HR=0.24,P<0.000 1)。
(二)ROS1
ROS1基因位于6号染色体长臂上的6q22,编码胰岛素受体家族亚类的受体酪氨酸激酶。ROS1融合基因的表达导致ROS1酪氨酸激酶的自磷酸化,通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路和RAS的磷酸化启动信号级联。这种组成性激活的酪氨酸激酶成为驱使细胞恶性增殖的驱动因子之一。ROS1融合基因在NSCLC中的阳性率为1.0%~3.4%,以CD74-ROS最为常见。推荐使用的ROS1融合检测方法有FISH、qRT-PCR、NGS和IHC。其中FISH检测是检测ROS1重排的金标准,但费用高,经济效益比不佳;基于qRT-PCR方法的ROS1融合基因检测具有较高的灵敏度和特异度,可以与其他靶点联合检测,但只能检测已知的ROS1融合基因;NGS检测ROS1基因变异同样可在DNA水平上检测重排序列或mRNA水平上检测融合转录本;而IHC检测不可直接用于ROS1基因重排的检测,只可用于初筛(表3)。
1.治疗推荐
(1)ROS1融合阳性患者一线治疗:对于ROS1融合阳性患者一线治疗推荐使用克唑替尼、恩曲替尼、瑞普替尼、安奈克替尼(3类,强)和塞瑞替尼(3类,中),见表4。若靶向治疗不可及,也可考虑使用含铂双药化疗联合或不联合贝伐珠单抗(1类,强)。
(2)ROS1融合阳性患者后线治疗:对于ROS1融合阳性患者克唑替尼治疗耐药后推荐使用含铂双药化疗联合或不联合贝伐珠单抗(1类,强),或瑞普替尼(3类,中),或入组临床研究,见表4。
2.ROS1融合阳性Ⅳ期NSCLC的治疗推荐证据
(1)ROS1融合阳性晚期NSCLC的一线治疗:Ⅰ期研究PROFILE 1001扩展队列入组了50例ROS1融合阳性晚期NSCLC患者,接受克唑替尼治疗的ORR为72%,中位PFS为19.2个月,中位DOR为24.7个月,中位OS为51.4个月,4年生存率为51%,大多数治疗相关AE为1~2级,无4级以上和导致永久停药的治疗相关AE。在东亚患者中的研究达到相近的疗效。3项Ⅱ期临床研究AcSe´、METROS和EUCROSS中,接受克唑替尼治疗的ORR分别为47.2%、65%和70%,发生的AE与ALK融合阳性患者接受克唑替尼治疗发生的AE相似。
STARTRK-2、STARTRK-1和ALKA-372-001 3项Ⅰ~Ⅱ期临床研究的汇总结果报道了172例未经ROS1-TKI治疗的局部晚期或转移性ROS1融合阳性NSCLC患者接受恩曲替尼治疗的疗效,ORR为67.4%,中位DOR为20.4个月,中位PFS为16.8个月,中位OS为44.1个月,脑转移患者颅内ORR为63.3%,颅内中位PFS为11.8个月,证实了恩曲替尼良好的全身疗效及颅内抗肿瘤活性。另一项回顾性队列研究比较了来自Flatiron数据库的克唑替尼真实世界数据与STARTRK-2、STARTRK-1和ALKA-372-001研究中恩曲替尼的疗效,结果显示,恩曲替尼较克唑替尼具有更长的中位PFS(分别为19.0和8.5个月)。
一项开放标签、多中心Ⅱ期临床研究报道了塞瑞替尼治疗ROS1融合阳性NSCLC患者的ORR和DCR分别为62%和81%,中位PFS、OS和DOR分别为9.3、24和21.0个月;最常见的AE为腹泻、恶心和厌食,可能与药物相关的严重AE发生率为22%。
瑞普替尼是新一代大环类ROS1或NTRK-TKI,Ⅰ~Ⅱ期临床研究TRIDENT-1报道了71例未经ROS1-TKI治疗的局部晚期或转移性ROS1融合阳性NSCLC患者接受瑞普替尼治疗的疗效,ORR为79%,中位DOR为34.1个月,中位PFS为35.7个月,1年无进展生存率为77%,中位OS未达到,1年生存率为91%;基线伴可测量脑转移患者颅内ORR为89%,1年颅内持续缓解率为83%;最常见的治疗相关AE为1~2级头晕。
安奈克替尼是新型ALK、ROS1、MET多靶点TKI,Ⅱ期单臂研究报道了111例未经ROS1-TKI治疗的ROS1融合阳性NSCLC患者接受安奈克替尼治疗的ORR为80.2%,中位PFS为16.5个月,中位DOR为20.3个月,基线伴脑转移患者的颅内ORR为72.7%。
(2)ROS1融合阳性晚期NSCLC的后线治疗:TRIDENT-1研究纳入100例既往接受过ROS1-TKI治疗的ROS1融合阳性NSCLC患者接受瑞普替尼治疗,其中56例患者仅接受过1种TKI而未接受化疗(队列4),26例患者接受过1种TKI和化疗(队列2),18例患者接受过2种TKI但未接受化疗(队列3)。结果显示,队列4患者的ORR为38%,中位PFS为9.0个月,中位OS为 25.1个月;队列2和队列3患者的ORR分别为42%和28%,中位DOR均为7.4个月。在18例既往接受克唑替尼治疗后仅出现脑转移进展的ROS1融合阳性肺癌患者中,接受恩曲替尼治疗后,2例达部分缓解(11%),4例为疾病稳定(22%),中位PFS为4.7个月,中位OS为43.5个月。
治疗ROS1融合阳性肺癌的靶向药物还包括恩沙替尼、洛拉替尼和Taletrectinib,但在国内外均未获批适应证。一项Ⅱ期单臂、多中心研究纳入既往化疗≤1线的ROS1融合阳性晚期NSCLC患者接受恩沙替尼治疗,ORR为27.0%,中位DOR和PFS分别为4.8和4.6个月。一项Ⅰ~Ⅱ期临床研究评估了洛拉替尼治疗ROS1融合阳性晚期NSCLC的疗效,共入组69例患者,克唑替尼耐药组(n=40)和初治组(n=21)患者的ORR分别为35%和62%,CNS转移的ORR分别为50%和64%。Taletrectinib是新型ROS1或NTRK-TKI,Ⅰ期研究入组8例NSCLC患者,6例经克唑替尼治疗耐药的ROS1阳性NSCLC患者的ORR为33%,中位PFS为4.1个月。Ⅱ期研究入组67例未经TKI治疗和42例克唑替尼耐药的ROS1融合阳性晚期NSCLC患者,ORR分别为92.5%和52.6%,DCR分别为95.5%和81.6%。
与EGFR或ALK-TKI耐药机制类似,ROS1-TKI耐药的机制主要有:①ROS1基因的继发突变,如克唑替尼耐药的点突变包括E1935G、L1947R、L1951R、G1971E、L1982F、S1986F/Y、L2026M、G2032R、D2033N、C2060G、V2098I和L2155S,塞瑞替尼耐药的点突变包括E1990G和F1994L,恩曲替尼耐药的点突变包括F2004C/I和G2032R。②RAS、EGFR、HER-2、MET、KIT、BRAF和MEK旁路或下游通路的激活。
(三)BRAF
BRAF是一种丝氨酸/苏氨酸蛋白激酶,在丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路中发挥相关作用,参与细胞生长、增殖、存活和分化。NSCLC中BRAF突变率约为1.5%~5.5%,其中以BRAF V600突变最为常见,占所有BRAF突变类型的30%~50%。针对BRAF突变的检测方法包括Sanger测序法、IHC、qRT-PCR和NGS等。Sanger测序法是突变检测金标准,但其检测敏感性较低;IHC法检测周期短,费用较低,但仅可针对V600E突变进行初筛;qRT-PCR的灵敏度和特异度均较高,但主要针对V600E突变,其他罕见V600突变可能会漏检;DNA-NGS检测是目前最推荐用于BRAF突变的检测方法,其同样具有较高的灵敏度和特异度,且可同时检测已知和未知的BRAF突变(表3)。
1.治疗推荐
(1)BRAF V600突变阳性患者一线治疗:对于BRAF V600突变阳性患者一线治疗,推荐应用达拉非尼联合曲美替尼(3类,强),见表4。
(2)BRAF V600突变阳性患者后线治疗:对于BRAF V600突变阳性患者后线治疗,若一线未使用靶向治疗,可选择达拉非尼联合曲美替尼方案靶向治疗(3类,强)。如一线靶向治疗进展后,可参考驱动基因阴性NSCLC的后线治疗方案(1类,强)。
2.BRAF V600突变阳性Ⅳ期NSCLC的治疗推荐证据
BRAF 113928研究是一项达拉非尼单药或联合用于晚期BRAF V600E突变NSCLC的Ⅱ期试验,分为3个队列,在达拉非尼单药队列中,ORR和DCR分别为33%和58%,中位DOR和PFS分别为9.6和5.5个月;35例(42%)患者出现3级以上AE。在联合治疗的经治患者队列中,达拉非尼联合曲美替尼的ORR和DCR分别为63.2%和78.9%,中位PFS和DOR分别为9.7和9.0个月;32例(56%)患者出现3级以上AE。在联合治疗的初治患者队列中,达拉非尼联合曲美替尼的ORR和DCR分别为64%和75%,中位PFS和OS分别为14.6和24.6个月。最新的5年随访数据显示了双药联合治疗的5年生存率达22%。达拉非尼联合曲美替尼的中国注册临床研究纳入20例初治或经治BRAF V600突变阳性NSCLC患者,全线ORR高达75%(95%CI:50.9%~91.3%),其中1例患者实现完全病理缓解,DCR为95%(95%CI:75.1%~99.9%)。中国真实世界研究结果显示,38例BRAF突变NSCLC患者一线治疗使用达拉非尼联合曲美替尼的中位PFS达25个月,1年无进展生存率为67%,2年无进展生存率达52%。
Encorafenib是一种口服、选择性、可逆性小分子RAF激酶抑制剂,Binimetinib是一种口服、可逆性MEK抑制剂。PHAROS研究是一项开放标签、多中心、单臂Ⅱ期临床研究,纳入98例伴有BRAF V600E突变且既往未使用BRAF或MEK抑制剂的转移性NSCLC患者,评估Encorafenib联合Binimetinib的疗效和安全性。59例一线治疗患者中,ORR为75%(95%CI:62%~85%);中位DOR不可估计(NE)(95%CI:23.1个月至NE);39例后线治疗患者中,ORR为46%(95%CI:30%~63%),中位DOR为16.7个月(95%CI:7.4个月至NE)。最常见的AE(≥25%)为疲劳、恶心、腹泻、肌肉骨骼疼痛、呕吐、腹痛、视力障碍、便秘、呼吸困难、皮疹和咳嗽。2023年10月11日,FDA批准了Enorafenib联合Binimetinib用于BRAF V600E突变转移性成人NSCLC。目前,上述药物适应证尚未获得国家药品监督管理局(National Medical Products Administration,NMPA)批准。
(四)RET
RET原癌基因位于染色体10q11.2,编码一种跨膜受体酪氨酸激酶,在胚胎发育期对器官生成、神经发育等起重要作用。当发生致癌变异时,RET激酶结构或功能发生改变,使其在没有配体结合的情况下也能被过度激活。这种不依赖配体的激活方式会导致细胞内信号通路的持续激活,从而促进细胞增殖,减少细胞凋亡。点突变和基因融合或重排是其常见的两种变异形式,在NSCLC中以后者多见。RET基因融合在NSCLC中的发生率为1%~2%,以KIF5B-RET和CCDC6-RET融合最为常见。对不可手术的Ⅲ~Ⅳ期或复发性NSCLC患者及对EGFR-TKI或ALK-TKI耐药的患者,建议行RET融合基因检测。但目前没有针对RET融合基因的标准检测方法,推荐的检测手段包括IHC、FISH、qRT-PCR和基于DNA或RNA的NGS。FISH是融合基因检测的金标准,但对于罕见变异类型可能漏检;强烈推荐使用NGS检测;目前暂不推荐IHC检测(表3)。
1.治疗推荐
(1)RET融合阳性患者一线治疗:对于RET融合阳性的晚期NSCLC一线治疗,推荐使用塞普替尼(1类,强)、普拉替尼治疗(3类,强),见表4;或参照驱动基因阴性晚期NSCLC治疗(1类,强)。
(2)RET融合阳性患者后线治疗:对于RET融合阳性的晚期NSCLC,若一线未使用靶向治疗,后线优先推荐使用塞普替尼(1类,强)和普拉替尼(3类,强),见表4;或参照驱动基因阴性晚期NSCLC治疗策略;若一线已使用靶向治疗,后线推荐参照驱动基因阴性晚期NSCLC治疗。
2.RET融合阳性的Ⅳ期NSCLC的治疗推荐证据
塞普替尼是一种口服的高选择性小分子RET激酶抑制剂,Ⅰ~Ⅱ期研究LIBRETTO-001显示,塞普替尼治疗RET融合阳性晚期NSCLC的一线ORR为85%,后线为64%;一线中位PFS未达到,后线为19.3个月;一线1年无进展生存率为68%,后线为66%;一线2年生存率为88%,后线为68%。其中基线合并脑转移患者的颅内ORR达91%。≥3级AE主要为高血压(12%)、ALT升高(8%)和AST升高(7%)等。Ⅲ期LIBRETTO-431研究比较了塞普替尼对比化疗联合帕博利珠单抗一线治疗RET融合阳性晚期NSCLC的疗效,结果显示,塞普替尼较化疗联合帕博利珠单抗可以显著改善患者的PFS(分别为24.8和11.2个月,HR=0.46,P<0.001)。基于上述结果,塞普替尼被NMPA批准用于一线或后线治疗晚期RET融合阳性的晚期NSCLC(1类,强)。
普拉替尼是一种口服的高选择性小分子RET激酶抑制剂。ARROW Ⅰ~Ⅱ期研究结果显示,普拉替尼治疗RET融合阳性晚期NSCLC的一线ORR为79%,后线为62%;中位PFS一线为13.0个月,后线为16.5个月;中位OS均未达到。脑转移患者也可获益,颅内ORR为56%(5/9),包括完全缓解(complete response,CR)3例(33%),6个月颅内持续缓解率为80%,12个月颅内持续缓解率为53%。≥3级AE主要为中性粒细胞减少症(19%)、高血压(12%)和贫血(13%)。目前,普拉替尼已被NMPA批准用于既往含铂化疗后进展RET融合阳性局部晚期或转移性NSCLC的治疗。
卡博替尼和凡德他尼均为非选择性RET激酶抑制剂。Ⅱ期研究显示,卡博替尼用于不可手术切除或转移性RET融合阳性NSCLC的ORR为28%,但73%的患者因严重AE减量。凡德他尼在一项治疗RET融合阳性晚期NSCLC的Ⅱ期研究中效果不理想,ORR仅为18%,中位PFS仅为4.5个月,中位OS为11.1个月。
RET融合阳性晚期NSCLC对化疗方案敏感,特别是铂类联合培美曲塞方案,患者的ORR约为 44.4%~52%,中位PFS约为6.6~9.2个月。因此,在靶向治疗无法获益的情况下,可以考虑全身治疗。免疫检查点阻断剂(immune checkpoint blockade,ICB)治疗RET融合阳性晚期NSCLC疗效有限,且均为小样本、回顾性研究。一项注册研究显示,ICB单药治疗RET基因融合晚期NSCLC的ORR仅为6%,中位PFS为2.1个月。
目前针对特异性RET融合靶向治疗NSCLC的耐药机制的报道较少,基于RET靶点的耐药突变主要为溶剂前沿突变(G810X),此外还有MET和KRAS扩增;多激酶抑制剂主要耐药机制为RET门卫基因突变(V804X)及RET激酶区突变(S904F)。
(五)MET
MET又称细胞间质上皮转化因子(cellular-mesenchymal-epithelial transition,c-MET),编码的产物肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR)是一种受体酪氨酸激酶(receptor tyrosine kinase,RTK),与其配体结合后可以激活PI3K-AKT、MAPK、STAT和核因子κB(nuclear factor κB,NF-κB)等多个信号通路,促进细胞生长、增殖、迁移和侵袭。MET异常主要包括MET 14外显子跳跃突变、MET基因扩增、MET基因点突变(主要是激酶区突变)、MET基因融合和MET蛋白过表达等。
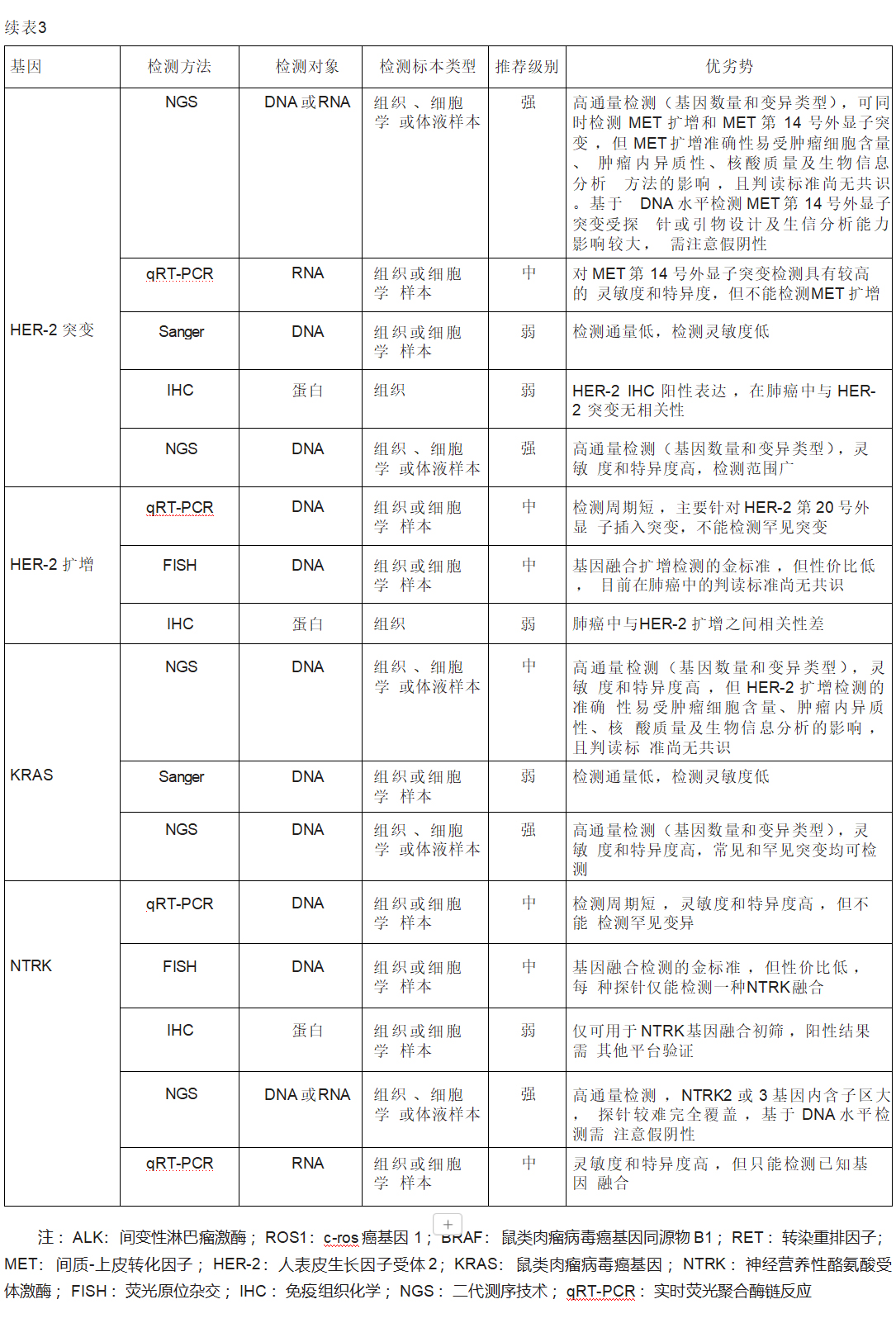
针对MET基因变异检测常用的检测手段有以下3种。(1)MET 14外显子跳跃突变:在NSCLC患者中发生率约为3%~4%,在肺肉瘤样癌患者中的发生率为9%~22%。目前常用的检测方法有:①RNA NGS或RT-PCR方法,是通过在RNA水平上检测 MET 13或15外显子融合来直接检测是否发生MET 14外显子跳跃突变;②基于DNA水平的NGS方法需覆盖MET 14外显子跳跃突变主要发生区域(包括MET基因14外显子和13或14内含子区域),否则会造成漏检。组织样本优先,液体活检样本可作为补充。不推荐IHC用于筛查MET 14外显子跳跃突变。(2)MET扩增:MET原发性扩增在NSCLC中的发生率约为1%~5%,MET继发扩增是EGFR-TKIs、ALK-TKI、ROS1-TKI和RET-TKI重要的耐药机制之一。在接受一、二代EGFR-TKI治疗的NSCLC中,约5%~22%的患者会继发MET扩增;在接受三代EGFR-TKI奥希替尼作为一线和二线治疗中,约7%~15%和5%~50%的患者会继发MET扩增;二、三代ALK-TKI耐药后也约有13%的患者会出现继发MET扩增。MET扩增检测方法的金标准为FISH检测。NGS也可用于检测MET扩增,但其准确性易受包括肿瘤细胞含量、肿瘤内异质性、DNA质量及生信分析等多种因素的影响,建议临床选用经NMPA批准或经充分验证的二代测序产品对MET基因扩增进行检测。当NGS检测MET扩增阴性时,可考虑FISH补充检测。优先考虑组织样本进行检测,血液检测阴性不能排除MET扩增,必要时考虑二次活检,FISH复核。(3)MET蛋白过表达:在NSCLC患者中的发生率约为30.4%~37%。MET过表达可使用IHC法进行检测,推荐使用组织样本,在组织样本不可获得的情况下,可尝试使用细胞学蜡块。在2023年11月发表的《非小细胞肺癌MET免疫组织化学检测和判读标准中国专家共识》中,对MET IHC检测流程、判读标准及检测报告形式进行了统一和规范,但目前不同患者人群的获益阈值,仍需进一步研究(表3)。
1.治疗推荐
(1)MET 14外显子跳跃突变阳性患者一线治疗:对于MET 14外显子跳跃突变的晚期NSCLC患者一线治疗,推荐使用谷美替尼(3类,强)、伯瑞替尼(3类,强)、赛沃替尼(3类,中),见表4。
(2)MET 14外显子跳跃突变阳性患者后线治疗:对于MET 14外显子跳跃突变晚期NSCLC患者,若一线未使用靶向治疗,后线推荐赛沃替尼(3类,强,表4)、谷美替尼(3类,强)、伯瑞替尼(3类,强),某些情况下可考虑克唑替尼治疗(3类,弱);若一线已使用靶向治疗,后线推荐参照驱动基因阴性晚期NSCLC治疗。
2.MET变异晚期NSCLC治疗推荐证据
(1)MET 14外显子跳跃突变晚期NSCLC的一线治疗:Ⅱ期GLORY研究显示,谷美替尼一线治疗MET 14跳跃突变的局部晚期或转移性NSCLC的ORR为66.7%。Ⅱ期KUNPENG研究显示,伯瑞替尼一线治疗MET 14跳跃突变局部晚期或转移性NSCLC的ORR为77.1%,中位PFS为14.4个月,中位OS为20.7个月;该研究还纳入5例脑转移患者,ORR为100%,中位PFS为17.9个月。Ⅲb期临床研究显示,赛沃替尼一线治疗MET 14外显子跳跃突变NSCLC的ORR为62.1%,DCR为92%,中位PFS为13.7个月,中位OS未达到。Ⅱ期研究显示,卡马替尼治疗MET 14外显子跳跃突变晚期NSCLC的一线ORR为68%,后线ORR为41%;一线DOR为12.6个月,后线为9.7个月;一线中位PFS为12.4个月,后线为5.4个月;最常见的AE为外周水肿(51%)和恶心(45%),且多为1~2级。Ⅱ期研究显示,特泊替尼一线治疗MET 14外显子跳跃突变(组织和液体活检阳性)晚期NSCLC的ORR为57.3%,DCR为78.7%,中位PFS为12.6个月,中位OS为21.3个月,其中组织活检阳性患者的ORR为58.6%,DCR为 83.8%,中位PFS为15.9个月,中位OS为29.7个月;亚洲人群的ORR达64%,中位PFS达16.5个月,中位OS达32.7个月,≥3级AE的发生率为25.1%,主要有外周水肿、呼吸困难和疲劳等。
克唑替尼是一种靶向ALK、ROS1和c-MET的多靶点、多激酶的小分子抑制剂。2项Ⅱ期研究AcSé和PROFILE 1001均评估了克唑替尼治疗MET 14外显子跳跃突变治疗晚期NSCLC的疗效,主要终点ORR分别为12%和32%,中位PFS为3.6和7.3个月。目前该药物仍缺乏中国人群数据,尚未获批相关适应证。
(2)MET 14外显子跳跃突变晚期NSCLC的后线治疗:赛沃替尼的Ⅱ期注册临床研究入组70例患者,初治患者28例(40%),后线治疗42 例(60%),脑转移患者15例(21%)。结果显示,赛沃替尼治疗MET 14外显子跳跃突变晚期NSCLC的ORR和DCR分别为49.2%和93.4%,中位PFS为6.8个月,常见的AE有转氨酶升高和外周水肿等。赛沃替尼已被NMPA批准用于标准含铂化疗后疾病进展或不能耐受标准含铂化疗的具有MET 14外显子跳跃突变局部晚期或转移性NSCLC患者的治疗。Ⅲb期临床研究显示,赛沃替尼后线治疗MET 14外显子跳跃突变NSCLC的ORR为39.2%,DCR为92.4%,中位PFS为11个月,中位OS为20.5个月。
Ⅱ期GLORY研究显示,谷美替尼后线治疗MET 14跳跃突变局部晚期或转移性NSCLC的ORR为51.9%。Ⅱ期KUNPENG研究显示,伯瑞替尼后线治疗MET 14跳跃突变局部晚期或转移性NSCLC的ORR为70.6%。
特泊替尼后线治疗MET 14外显子跳跃突变(组织或液体活检 阳性)晚期NSCLC的ORR为 45%,DCR为73.8%,中位PFS为11个月,中位OS为19.3个月,其中组织活检阳性患者的ORR为49.5%,DCR为78.4%,中位PFS为11.5个月,中位OS为20.4个月。
目前针对MET抑制剂治疗晚期NSCLC的耐药机制主要是关于MET抑制剂治疗MET 14外显子跳跃突变患者耐药的数据报道,主要包括MET激酶结构域突变、MET 14外显子扩增,由ERBB家族、BRAF、KRAS扩增和KRAS突变引起的旁路激活以及PI3K信号通路激活等。
3.其他MET变异类型的治疗
(1)MET扩增晚期NSCLC的治疗:①MET原发扩增:MET抑制剂可能为原发MET高度扩增晚期NSCLC患者带来获益,仍需要进一步探索。不同研究界定MET扩增的阈值存在差异,如特泊替尼,MET基因拷贝数(gene copy number,GCN)≥2.5,初治ORR为71.4%(5/7);卡马替尼,MET GCN≥10,初治ORR为40%(6/15),中位PFS为4.2个月;克唑替尼,MET/CEP7≥4,ORR为40%(8/20),中位PFS为 6.7个月。②MET继发扩增:目前针对EGFR-TKI治疗耐药后继发MET扩增患者的主要治疗方式是采用靶向药物联合治疗,如特泊替尼+吉非替尼、特泊替尼+奥希替尼、卡马替尼+吉非替尼或赛沃替尼+奥希替尼等,联合治疗的ORR约为 8%~48%,中位PFS约为4.9~7.6个月。此外,在接受ALK-TKI治疗的患者中,约13%的患者会继发MET扩增,个案报道显示,克唑替尼可能克服耐药。继发于RET或ROS1的TKI耐药的MET扩增均来自小样本或个案报道,缺乏高水平证据。整体而言,基于EGFR、ALK、RET、ROS1的TKI耐药后继发MET扩增靶向联合治疗的相关研究正在开展,目前缺乏高水平证据。
(2)MET过表达晚期NSCLC的治疗:有研究显示,MET抗体偶联药物(antibody drug conjugate,ADC)Telisotuzumab vedotin在EGFR野生型、MET蛋白过表达MET IHC 3+的晚期经治NSCLC患者中ORR达到53.8%,展示出有临床意义的肿瘤应答。基于此项Ⅱ期研究,Telisotuzumab vedotin获得了FDA突破性疗法认证,相应的Ⅲ期临床研究(NCT04928846)正在进行中。
INSIGHT和TATTON研究显示,EGFR-TKI耐药后MET IHC 3+的患者可能从EGFR-TKI联合MET-TKI治疗中获益,而IHC 2+亚组对双靶治疗反应不佳,提示MET蛋白过表达可能作为NSCLC靶向治疗的生物标志物,亟需进一步探索和研究。
(3)其他治疗:埃万妥单抗(Amivantamab)是首个靶向EGFR和c-MET的人源化双特异性抗体,目前已被美国FDA批准用于治疗既往接受含铂治疗后疾病进展的EGFR 20外显子突变阳性的晚期NSCLC。Ⅰ期CHRYSALIS研究显示,埃万妥单抗联合第三代EGFR-TKI(Lazertinib)治疗奥希替尼耐药(包括继发MET扩增的患者)、未经化疗的晚期EGFR突变型NSCLC患者具有良好的抗肿瘤活性,45例接受联合治疗的患者中,ORR为36%,中位PFS达到4.9个月。目前该药物尚未在国内获批上市,正在开展多项临床试验。此外,临床前研究显示,MET扩增会下调STING表达,减弱干扰素的反应,从而影响ICB的疗效。因此,MET抑制剂联合ICB治疗可能克服MET扩增引起的ICB抗性,产生协同效应。一项卡马替尼联合纳武利尤单抗治疗EGFR野生型晚期NSCLC患者的Ⅱ期临床研究显示,MET高表达患者比MET低表达患者有更高的ORR和DCR及更长的PFS和OS,但该研究样本量有限,尚需扩大样本量进一步研究验证。
(六)HER-2
HER-2即ERBB2,属于原癌基因,其编码产物HER-2蛋白具有酪氨酸激酶活性,属于ERBB受体酪氨酸激酶家族中的一员。HER-2与其他家族成员形成同源或异源二聚体后会引起受体酪氨酸残基的磷酸化,并启动包括MAPK、PI3K/AKT、STAT等在内的多种信号通路激活,导致细胞增殖和肿瘤发生。HER-2在NSCLC中的主要变异形式包括突变(1%~4%)、扩增(2%~5%)和过表达(2%~30%),以基因突变最具有临床意义,其中20号外显子插入突变(A775_G776YVMA)最为常见,约占83%。HER-2突变和扩增常见于亚裔、女性、不吸烟和腺癌患者。对不可手术的Ⅲ~Ⅳ期或复发性NSCLC患者及EGFR-TKI耐药患者,建议行HER-2扩增或突变检测。目前获批用于检测HER-2扩增和过表达的手段有IHC、FISH和NGS。FISH检测为HER-2扩增检测的金标准,对于IHC 2+者可用FISH检测复核;NGS检测HER-2扩增的准确性易受肿瘤细胞含量、肿瘤内异质性、核酸质量及生物信息分析的影响,且判读标准尚无共识,暂不作为强烈推荐方法。针对HER-2突变目前尚无标准检测方法,可选择的检测方法包括Sanger测序、IHC、NGS和qRT- PCR(表3),其中NGS检测方法灵敏度和特异度较高,检测范围广,推荐应用。
1.治疗推荐
(1)HER-2突变阳性患者一线治疗:对于HER-2突变阳性晚期NSCLC患者一线治疗,推荐参照驱动基因阴性晚期NSCLC治疗(1类,强)。
(2)HER-2突变阳性患者后线治疗:对于HER-2突变的晚期NSCLC后线治疗,优先推荐参照驱动基因阴性晚期NSCLC治疗,或使用德曲妥珠单抗(T-DXd,3 类,中)、吡咯替尼(3类,弱)。再次进展者,推荐参照驱动基因阴性晚期NSCLC治疗。
(3)HER-2蛋白过表达患者后线治疗:对于HER-2蛋白过表达的晚期NSCLC后线治疗,优先推荐参照驱动基因阴性晚期NSCLC治疗,或使用德曲妥珠单抗(T-DXd)治疗(3类,中)。再次进展者,推荐参照驱动基因阴性晚期NSCLC治疗。
2.HER-2突变阳性晚期NSCLC的治疗推荐证据
(1)HER-2突变阳性晚期NSCLC患者的一线治疗:目前尚无HER-2阳性晚期NSCLC的针对性一线治疗,推荐参照驱动基因阴性晚期NSCLC一线治疗方案,可以选择含铂化疗和(或)ICB治疗,根据病理类型可以选择不同的化疗方案。此外,一些回顾性分析显示,ICB单药二线治疗HER-2突变晚期NSCLC收获甚微,ORR仅为6%~7.4%,中位PFS只有1.9~2.5个月,与化疗相似。
(2)HER-2突变阳性晚期NSCLC患者的后线治疗:①抗体偶联药物:德曲妥珠单抗即T-DXd、DS-8201,是一种新型ADC,由抗HER-2抗体、可切割的四肽连接物和拓扑异构酶Ⅰ抑制剂有效载荷组成。在Ⅱ期多中心DESTINY-Lung01研究中,纳入91例对标准方案治疗抵抗的HER-2突变晚期NSCLC患者,包括81例(89%)20号外显子突变,4例(4.4%)19号外显子突变和6例(6.6%)8号外显子突变,其中20号外显子插入突变占85.7%(78/91),结果显示,德曲妥珠单抗治疗的ORR为55%(95%CI:44%~65%),中位DOR为9.3个月,中位PFS为8.2个月,中位OS为17.8个月。DESTINY-Lung02研究是一项盲法、多中心Ⅱ期研究,纳入152例既往接受过含铂治疗的HER-2突变转移性NSCLC患者,探索不同剂量组德曲妥珠单抗的疗效,当用药剂量分别为5.4 mg/kg和6.4 mg/kg时,经证实的ORR分别为49.0%(95%CI:39.0%~59.1%)和56.0%(95%CI:41.3%~70.0%),中位DOR分别为16.8个月(95%CI:6.4个月至 NE)和NE(95%CI:8.3个月至NE);分别有38.6%(39/101)和58.0%(29/50)的患者发生≥3级药物相关AE,分别有12.9%(13/101)和28.0%(14/50)的患者发生药物相关性间质性肺疾病(2组各有2.0%分级≥3级)。我国开展的一项开放标签、Ⅱ期临床研究 DESTINY-Lung05显示,在72例既往经治HER-2突变晚期NSCLC患者中,接受5.4 mg/kg德曲妥珠单抗治疗后ORR为58.3%,研究者评估的中位PFS为10.8个月。恩美曲妥珠单抗(T-DM1)是另一种ADC药物,由抗HER-2靶向药物曲妥珠单抗与微管抑制剂DM1通过硫醚连接子连接而成。一项Ⅱ期研究纳入18例(3例为初治)HER-2突变晚期非鳞NSCLC患者,包括11例(61.1%)20号外显子突变(8例为20号外显子插入突变),2例(11.1%)19号外显子突变,2例(11.1%)17号外显子突变,3例(16.7%)8号外显子突变。整体人群ORR为44%,中位PFS为5个月,整体耐受良好,AE主要为1~2级,包括输液反应、血小板减少和转氨酶升高等,无因AE停药和药物相关性死亡。恩美曲妥珠单抗在HER-2扩增晚期NSCLC中也具有良好效果,ORR达55%。然而,恩美曲妥珠单抗单药治疗HER-2过表达经治转移性NSCLC的Ⅱ期研究却因疗效有限而提前终止,在15例HER-2阳性(3例IHC 2+、5例IHC 3+和FISH阳性、7例20号外显子插入突变)患者中,只有1例HER-2 20号外显子插入突变患者观察到部分缓解。因此,仍需要进一步探索不同HER-2变异类型的治疗模式,实现精准治疗。目前,美国FDA批准德曲妥珠单抗用于HER-2突变晚期NSCLC的后线治疗。②小分子靶向治疗:目前在HER-2突变晚期NSCLC中疗效较好的小分子TKI有吡咯替尼和莫博赛替尼,其他如阿法替尼、达克替尼、来那替尼在HER-2突变型肺癌患者中均疗效欠佳。吡咯替尼是一种国产不可逆的泛-HER受体小分子TKI,与阿法替尼和恩美曲妥珠单抗(T-DM1、HER-2 ADC药物)相比,吡咯替尼在HER-2 20号外显子插入突变的人源性组织异种移植(patient-derived xenografts,PDX)模型中具有优越的抗肿瘤活性,使用吡咯替尼治疗组小鼠的平均肿瘤体积明显缩小,而阿法替尼和恩美曲妥珠单抗组的肿瘤体积无明显变化。临床研究显示,吡咯替尼治疗15例HER-2 20号外显子突变(包括10例A775_G7 76insYVMA、1例P780_Y781insGSP,1例G776>IC,1例G776>VC,1例G776C,1例L755P)NSCLC患者具有良好的疗效,ORR为53.3%,中位PFS为6.4个月。一项多中心Ⅱ期单臂临床研究纳入60例接受含铂方案治疗的HER-2 20号外显子突变型晚期肺腺癌患者,结果显示,吡咯替尼在所有突变亚组(p.A775_G776insYVMA、p.M774_A775insAYVM;p.G776>VC、p.G776R、p.G776;p.P780_Y781 insGSP;p.V777L;p.L755P)均观察到获益,全组人群的ORR为30%,DOR为6.9个月,中位PFS为6.9个月,中位OS为14.4个月;3~4级AE发生率为28.3%,主要为腹泻(20%)。目前,吡咯替尼已在中国获批上市,主要适用于治疗HER-2阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。莫博赛替尼是针对 HER2 20插入突变的小分子抑制剂。Ⅰ~Ⅱ期研究显示,莫博赛替尼治疗一线含铂化疗失败HER-2 20插入突变晚期NSCLC的ORR为28%,中位PFS为7.3个月,中位OS为24个月,基线有脑转移和无脑转移患者的ORR分别为18%和34%。波齐替尼是一种广谱HER-TKI,可阻断HER-1、HER-2和HER-4信号通路。Ⅱ期研究ZENITH20显示,在既往治疗失败的EGFR或HER-2 20号外显子插入突变晚期NSCLC患者中的ORR为27.8%,DCR为70%,中位PFS为5.5个月。但由于AE发生率较高且严重,83.3%的患者发生了≥3级AE,76.7%的患者需要减量,现已终止在中国的临床试验。目前关于HER-2靶向治疗晚期NSCLC耐药机制的研究较少。体外研究显示,C805S是HER-2 20号外显子插入突变患者接受波齐替尼治疗的潜在获得性耐药机制。一项来自曲妥珠单抗和阿法替尼等靶向药物治疗的HER-2突变晚期NSCLC患者的回顾性研究显示,IK3CA(R88Q)和HER-2扩增是其潜在的耐药原因。
3.HER-2过表达晚期NSCLC的治疗推荐证据
对于HER-2蛋白过表达NSCLC,DESTINY-Lung01研究的队列1中HER-2蛋白过表达(IHC 2+或3+)数据队列,提示德曲妥珠单抗6.4 mg/kg和5.4 mg/kg每3周1次的ORR分别为26.5%和34.1%,DOR分别为5.8和6.2个月,中位PFS分别为5.7和6.7个月,中位OS分别为12.4和11.2个月。基于DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CEC02研究,美国FDA获批用于既往接受过系统治疗且没有其他有效治疗方案的不可切除或转移性 HER-2阳性(IHC3+)的成人实体瘤患者。在DESTINY-Lung 01中,接受德曲妥珠单抗治疗的HER-2阳性(IHC 3+)NSCLC患者确认的ORR为52.9%,中位DOR为6.9个月。
(七)KRAS
KRAS属于RAS基因家族中的一员。KRAS突变多见于吸烟患者,在中国NSCLC中的发生率约10%。KRAS突变常发生于其编码蛋白的第12(G12)、13(G13)和61(Q61)位氨基酸对应的密码子,其中G12C突变最为常见,约为39%,其次是G12V突变(18%~21%)和G12D(17%~18%)。对不可手术的Ⅲ~Ⅳ期或复发性NSCLC患者及EGFR-TKI治疗后耐药的患者,建议行KRAS突变检测。目前尚无针对KRAS突变的标准检测方法,常用的检测手段包括NGS、qRT-PCR和Sanger测序(表3)。
1.治疗推荐
(1)KRAS G12C突变患者一线治疗:对于KRAS突变的晚期NSCLC一线治疗,推荐参照驱动基因阴性晚期NSCLC治疗(1类,强)。
(2)KRAS G12C突变患者后线治疗:对于KRAS G12C突变的晚期NSCLC后线治疗,优先推荐参照驱动基因阴性晚期NSCLC治疗,或使用索托拉西布(Sotorasib)治疗(2 类,中)、阿达格拉西布(Adagrasib)治疗(3类,中),或入组临床研究。再次进展者,参照驱动基因阴性晚期NSCLC治疗。
2. KRAS突变晚期NSCLC的治疗推荐证据
(1)KRAS G12C突变晚期NSCLC患者的一线治疗:有学者对60例KRAS突变的晚期NSCLC进行回顾性分析,KRAS突变与非突变患者一线接受含铂方案化疗的中位PFS(分别为4.0和4.5个月,P=0.16)和中位OS(分别为7.0和9.3个月,P=0.25)相似。针对不同化疗方案,一项纳入464例晚期KRAS突变NSCLC患者的回顾性分析显示,紫杉醇方案较其他方案具有更高的ORR和更长的PFS(与培美曲塞方案比较),且在紫杉醇方案中,联合了贝伐珠单抗的患者ORR可提高至62%,但两组OS无差异。在既往关于ICB的临床研究中,均纳入KRAS突变患者。Ⅲ期临床研究KEYNOTE-042中纳入69例(22.9%)KRAS突变患者,其中29例(9.6%)为KRAS G12C突变,KRAS突变患者具有更高的PD-L1表达水平和更高的肿瘤突变负荷(tumor mutational burden,TMB)状态,与含铂化疗相比,帕博利珠单抗在PD-L1阳性晚期NSCLC中具有更高的ORR(分别为56.7%和18.0%)和更长的PFS(分别为12和6个月,HR=0.51,95%CI:0.29~0.87)和 OS(分别为28和11个月,HR=0.42,95%CI:0.22~0.81)。在联合化疗上,Ⅲ期研究KEYNOTE-189中纳入89例(31%)KRAS突变的转移性非鳞NSCLC患者,其中37例(13%)为KRAS G12C突变。无论KRAS突变状态如何,帕博利珠单抗联合化疗优于安慰剂联合化疗。关于后线治疗,Ⅲ期研究CheckMate 057中纳入62例KRAS突变患者,结果显示,二线使用纳武利尤单抗优于多西他赛,可显著改善患者的OS(HR=0.52,95%CI:0.29~0.95)。OAK研究亚组分析结果显示,KRAS突变患者使用阿替利珠单抗治疗的中位OS优于多西他赛(HR=0.71,95%CI:0.38~1.35)。KRYSTAL-7研究评价了阿达格拉西布联合帕博利珠单抗一线治疗KRAS G12C突变局部晚期或转移性NSCLC的疗效,结果显示,双药联合在PD-L1≥50%的人群中具有更高的ORR,可达63%,DCR达84%,中位PFS尚未达到。
(2)KRAS G12C突变晚期NSCLC患者的后线治疗:①TKI治疗:EGFR位于KRAS的上游,KRAS突变的NSCLC对EGFR-TKI原发耐药。Meta分析显示,在EGFR-TKI治疗未经选择的晚期NSCLC中,KRAS突变患者预后较差(OS:HR=2.09,95%CI:1.56~2.80;PFS:HR=1.82,95%CI:1.50~2.20)。其他如RAF、MEK、mTOR等KRAS下游信号通路关键效应因子的抑制剂在NSCLC中的治疗效果均有限。②KRAS G12C抑制剂:索托拉西布(代号AMG 510)是首个上市的针对KRAS G12C的口服抑制剂。Ⅰ期研究(CodeBreak 100)未观察到剂量限制毒性,无治疗相关死亡,3或4级治疗相关AE的发生率为11.6%。在Ⅱ期研究中,共入组126例至少接受过1种全身治疗携带KRAS G12C突变的NSCLC患者,81%的患者接受过含铂化疗和ICB治疗。总ORR为37.1%,DCR为80.6%,中位DOR为11.1个月,中位PFS为6.8个月,中位OS为12.5个月(95%CI:10.0个月至未达到)。全球多中心Ⅲ期临床试验(CodeBreak 200)对比了索托拉西布和多西他赛用于KRAS G12C突变的晚期NSCLC患者后线治疗的疗效,结果显示,索托拉西布较多西他赛可显著改善患者的PFS(分别为5.6和4.5个月,HR=0.66,P=0.001 7),但次要终点OS未获益(分别为10.6和11.3个月,HR=1.01,95%CI:0.77~1.33,P=0.53)。阿达格拉西布(MRTX849)是另一种高选择性KRAS G12C口服抑制剂。KRYSTAL-1研究显示,阿达格拉西布治疗KRAS G12C晚期NSCLC的ORR为43%(55/128),中位PFS为6.9个月,中位OS为14.1个月,最常见的3~4级AE为乏力(15%),未观察到最大耐受剂量。正在进行的Ⅲ期KRYSTAL-12研究比较了阿达格拉西布对比多西他赛用于KRAS G12C晚期NSCLC患者后线治疗的疗效,主要研究终点为PFS。近年来,出现了很多新型的KRAS G12C小分子抑制剂,如Garsorasib(D-1553)、福泽雷赛(IBI351)、JDQ443等。Ⅰ期临床研究(NCT05383898)结果显示,Garsorasib后线治疗KRAS G12C突变 NSCLC患者的ORR和DCR分别为40.5%和91.9%,中位PFS为8.2个月,中位DOR为7.1个月;最常见的≥3级AE为肝功能异常和消化系统反应。Ⅱ期研究中,福泽雷赛治疗标准治疗失败或不耐受且携带KRAS G12C突变的晚期NSCLC的ORR为46.6%,DCR为90.5%,中位PFS为8.3个月。在27例接受JDQ443治疗的NSCLC患者中,ORR在所有剂量水平组为44.4%,在推荐剂量200 mg、2次/d组为57.1%。现有数据显示,接受KRAS G12C抑制剂治疗后的耐药原因主要包括G12D/R/V/W、G13D、Q61H、R68S、H95D/Q/R、Y96C和KRAS G12C等位基因的高水平扩增,MET扩增,NRAS、BRAF、MAP2K1和RET突变,ALK、BRAF、RAF1和FGFR3融合以及NF1和PTEN缺失突变等。
(八)NTRK
原肌球蛋白相关激酶(tropomyosin-related kinase,TRK)蛋白是一类神经生长因子受体,属于酪氨酸激酶,TRK家族共包含3个高度同源蛋白——TRKA、TRKB、TRKC,这3个蛋白分别由NTRK1、NTRK2和NTRK3基因编码。TRK与细胞增殖、分化、代谢、凋亡等密切相关。NTRK融合基因在NSCLC中发生率<0.2%。IHC仅被推荐用于NTRK融合的初筛;qRT-PCR法检测NTRK融合基因灵敏度和特异度均较高,但仅能检测已知基因融合;FISH是目前基因融合检测的金标准,但性价比低,每种探针仅能检测一种NTRK融合;NGS方法可进行多重检测、敏感性高,被强烈推荐用于NTRK融合的检测,需要注意NTRK2、NTRK3基因内含子区大,探针较难完全覆盖,需警惕存在假阴性(表3)。
1.治疗推荐
(1)NTRK融合阳性患者一线治疗:对于NTRK融合阳性患者一线治疗,可以考虑使用恩曲替尼、拉罗替尼(3类,强),见表4;也可推荐参考驱动基因阴性NSCLC一线治疗方案(1类,强)。
(2)NTRK融合阳性患者后线治疗:对于NTRK融合阳性患者后线治疗,推荐参考驱动基因阴性NSCLC后线治疗方案(1类,强)。若前线治疗未使用靶向药物,可以考虑使用恩曲替尼、拉罗替尼(3类,强),见表4。
2.NTRK融合阳性Ⅳ期NSCLC的治疗证据
2019年FDA已经批准恩曲替尼、拉罗替尼用于NTRK融合基因阳性NSCLC的治疗,NMPA于2022年批准上述药物适应证。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐恩曲替尼、拉罗替尼用于NTRK融合阳性转移性或晚期NSCLC一线治疗。
在靶向治疗方面,ALKA-372-001、STARTRK-1和STARTRK-2临床研究的汇总结果显示,51例NSCLC患者接受恩曲替尼治疗的ORR为61.3%,中位DOR为20.0个月。对于20例基线伴有CNS转移的患者,恩曲替尼的颅内控制率也较好,基线伴脑转移患者的CNS ORR达60%。此外,一项Ⅰ~Ⅱ期研究纳入17个癌种、55例NTRK融合阳性患者接受拉罗替尼治疗,整体ORR为75%,治疗1年时有55%的患者尚未进展,中位DOR和OS均未达到,大多数AE为1级。
治疗NTRK融合阳性NSCLC的药物还有瑞普替尼,但目前国内外尚未获批适应证。TRIDENT-1 Ⅰ~Ⅱ期研究结果显示,21例初治和14例经治NSCLC患者接受瑞普替尼治疗的ORR分别为62%和43%,1年无进展生存率为64%和23%,最常见的AE是头晕,大多数为低级别。
NTRK融合阳性发生率相对较低,关于其耐药的机制尚无较为明确的研究结论,有学者描述RAS、MET、ERBB2或BRAF的热点突变或扩增是NTRK抑制剂获得性耐药的可能原因。
四、总结
自分子靶向药物实际投入临床应用以来,晚期NSCLC的治疗预期与治疗格局有了很大改变,分子病理检测成为正式进入治疗前的必需步骤,指导药物治疗的整体走向。尽管单个罕见基因突变携带者在整体肺癌患者中的比例相对较小,但考虑到复杂罕见靶点的多样性,累积起来已构成了一个数量可观的患者群体。这些患者迫切需要疗效更佳、更具针对性的药物治疗方案。针对各类罕见靶点突变,国际上仍有更新的药物临床试验不断涌现,以期为携带不同类型罕见基因突变的患者提供更佳治疗选择。通过明确患者携带的基因突变,可以对患者的预后、治疗反应等起到一定预测作用,进而针对性给予综合性、个体化精准治疗。从恶性肿瘤的早诊、早治来看,精准靶向治疗不仅可以使晚期肺癌患者受益,未来也可以将受益人群扩大至中、早期患者,在辅助治疗、新辅助治疗等领域取得成效。目前,原发性肺癌罕见靶点靶向治疗的研究进程仍在稳步推进中,还有许多科学问题亟待更多的临床研究及转化研究探究和解答。
本指南在参考国内外肺癌诊疗指南和规范及分子靶向治疗相关大型临床试验、研究的基础上拟定,在临床实际诊疗中尚需结合个体具体情况进行实践,仅作参考。
专家组顾问 赫捷(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科)、于金明(山东省肿瘤医院放疗科)、吴一龙(广东省人民医院肺外科 广东省肺癌研究所)
专家组组长 王洁(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
专家组成员(按姓氏汉语拼音字母排序) 毕楠(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院放疗科)、陈昶(上海肺科医院胸外科)、 陈椿(福建医科大学附属协和医院胸外科)、 陈海泉(复旦大学附属肿瘤医院胸外科)、陈克能(北京大学肿瘤医院胸外科)、陈亮(江苏省人民医院胸外科)、陈明(中山大学肿瘤防治中心放疗科)、程颖(吉林省肿瘤医院肿瘤内科)、褚倩(华中科技大学同济医学院附属同济医院胸部肿瘤科)、段建春(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、樊旼(复旦大学附属肿瘤医院放疗科)、范云(中国科学院大学附属肿瘤医院 浙江省肿瘤医院胸部肿瘤内科)、方文涛(上海交通大学附属胸科医院胸外科)、付向宁(华中科技大学同济医学院附属同济医院胸外科)、傅小龙(上海交通大学附属胸科医院放疗科)、高树庚(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科)、葛红(郑州大学附属肿瘤医院 河南省肿瘤医院放疗科)、郭石平(中国医学科学院肿瘤医院山西医院 山西省肿瘤医院胸外科)、郭其森(山东省肿瘤医院 山东第一医科大学附属肿瘤医院呼吸内科)、韩宝惠(上海交通大学附属胸科医院 上海市胸科医院呼吸内科)、何建行(广州医科大学附属第一医院胸外科)、胡坚(浙江大学医学院附属第一医院胸外科)、胡毅(解放军总医院肿瘤内科)、黄诚(福建省肿瘤医院胸部肿瘤内科)、 黄鼎智(天津医科大学肿瘤医院肿瘤内科)、 黄云超(云南省肿瘤医院 昆明医科大学第三附属医院胸外科)、惠周光(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院放疗科)、李国辉(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院药剂科)、李鹤成(上海交通大学医学院附属瑞金医院胸外科)、李建成(福建省肿瘤医院胸部放疗科)、李卫华(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院病理科)、林冬梅(北京大学肿瘤医院病理科)、林根(福建省肿瘤医院肿瘤内科)、林劫(昆明医科大学第二附属医院肿瘤科)、刘安文(南昌大学第二附属医院肿瘤科)、刘宏旭(辽宁省肿瘤医院胸外科)、 刘俊峰(河北医科大学第四医院胸外科)、刘伦旭(四川大学华西医院胸外科)、刘云鹏(中国医科大学附属第一医院肿瘤内科)、刘喆(首都医科大学附属北京胸科医院肿瘤内科)、陆舜(上海市胸科医院肿瘤科 上海市肺部临床医学中心)、马冬春(安徽省胸科医院胸外科)、马智勇(郑州大学附属肿瘤医院 河南省肿瘤医院 河南省肺癌诊疗中心)、牟巨伟(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科)、沈波(江苏省肿瘤医院 南京医科大学附属肿瘤医院内科)、宋启斌(武汉大学人民医院肿瘤中心)、孙大强(天津市胸科医院胸外科)、孙伟(海南医学院第二附属医院胸外科)、谭锋维(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科)、田辉(山东第一医科大学第一附属医院胸外科)、王长利(天津医科大学肿瘤医院肺部肿瘤科)、王慧娟(郑州大学附属肿瘤医院 河南省肿瘤医院呼吸内科)、王建卫(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院影像诊断科)、王军(河北医科大学第四医院放疗科)、王丽萍(郑州大学第一附属医院肺癌中心)、王绿化(中国医学科学院肿瘤医院深圳医院放疗科)、王孟昭(中国医学科学院北京协和医院呼吸与危重症医学科)、王文祥(湖南省肿瘤医院胸部肿瘤外科中心)、王志杰(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、魏文强(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院全国肿瘤登记办公室)、邬麟(中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院胸部内科)、吴楠(北京大学肿瘤医院胸部肿瘤中心)、吴宁(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院影像诊断科)、吴永忠(重庆大学附属肿瘤医院放疗科)、辛华(吉林大学中日联谊医院胸外科)、徐世东(哈尔滨医科大学附属肿瘤医院胸外科)、薛涛(东南大学附属中大医院胸心外科)、杨帆(北京大学人民医院胸外科)、杨农(中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院肺胃肠肿瘤内科)、姚文秀(四川省肿瘤医院内科)、姚煜(西安交通大学第一附属医院肿瘤内科)、应建明(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院病理科)、袁智勇(天津医科大学肿瘤医院放疗科)、张红梅(空军军医大学西京医院肿瘤科)、张兰军(中山大学肿瘤防治中心胸外科)、张力(中山大学肿瘤防治中心内科)、张毅(首都医科大学宣武医院胸外科)、赵军(北京大学肿瘤医院胸部肿瘤中心)、赵松(郑州大学第一附属医院胸外科)、赵心明(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院影像诊断科)、钟文昭(广东省人民医院肺外科 广东省肺癌研究所)、周彩存(同济大学附属东方医院肿瘤科)、周承志(广州医科大学附属第一医院呼吸与危重症医学科)、朱波(陆军军医大学新桥医院肿瘤科)、朱正飞(复旦大学附属肿瘤医院放射治疗中心)
执笔人 王志杰、仲佳(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、李卫华(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院病理科)
学术秘书 赵杰、朱以香、吴鑫宇(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
利益冲突 所有作者声明无利益冲突

附件下载:《中国肿瘤临床与康复》稿约.pdf